Tabela Periódica: Como Organizar os Elementos Químicos
Introdução
A Tabela Periódica dos Elementos é uma das ferramentas mais importantes da química, fornecendo uma maneira sistemática de organizar todos os elementos químicos conhecidos. Ela não apenas facilita a identificação dos elementos e suas propriedades, mas também permite prever comportamentos e reações químicas. A disposição dos elementos na tabela não é arbitrária, mas segue uma organização baseada em suas características físicas e químicas, que foram descobertas ao longo de muitos anos de experimentação e análise. Neste resumo, exploraremos os principais conceitos relacionados à Tabela Periódica, os critérios para a organização dos elementos, exemplos de aplicação prática, e sua importância no estudo da química.
O que é a Tabela Periódica?
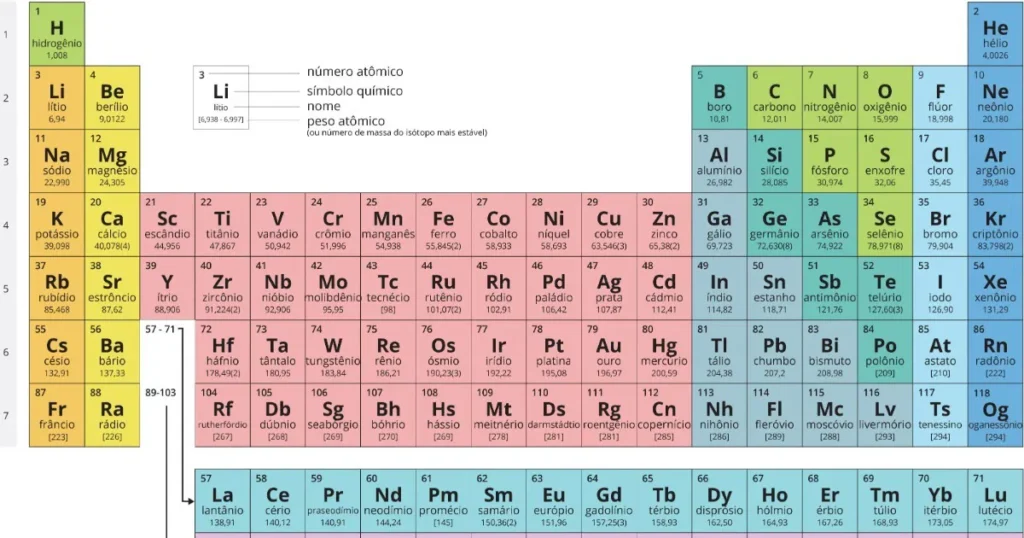
A Tabela Periódica é uma disposição tabular dos elementos químicos, organizada de acordo com suas propriedades e números atômicos. Os elementos são arranjados em linhas horizontais chamadas de períodos e em colunas verticais chamadas de grupos ou famílias.
- Períodos: São as linhas horizontais da tabela, que indicam o número de camadas eletrônicas de um átomo. Os elementos de um mesmo período possuem a mesma quantidade de camadas eletrônicas, mas suas propriedades variam de acordo com o aumento do número atômico.
- Grupos: São as colunas verticais da tabela. Os elementos de um mesmo grupo possuem propriedades semelhantes, pois têm a mesma quantidade de elétrons na camada mais externa (camada de valência). A tabela moderna tem 18 grupos, numerados de 1 a 18, sendo que os grupos 1, 2, 13, 14, 15, 16, 17 e 18 são conhecidos como os grupos principais, enquanto os outros são os elementos de transição.
Como Organizar os Elementos na Tabela Periódica
A organização dos elementos na Tabela Periódica segue alguns princípios fundamentais:
- Número Atômico: O número atômico de um elemento (representado por \( Z \)) é o número de prótons no núcleo de um átomo desse elemento. Ele determina a identidade do elemento e a sua posição na tabela. A organização dos elementos é feita em ordem crescente de número atômico, de modo que os elementos se encontram alinhados conforme o aumento do número de prótons.
- Configuração Eletrônica: Os elementos de um mesmo grupo têm configurações eletrônicas semelhantes, o que confere propriedades químicas parecidas. Por exemplo, os gases nobres (grupo 18) possuem uma camada de valência completa, o que torna esses elementos extremamente estáveis e pouco reativos.
- Propriedades Periódicas: Ao longo da tabela, certas propriedades dos elementos exibem um padrão periódico, como o raio atômico, a eletronegatividade e a energia de ionização. Essas propriedades variam com a posição na tabela:
- Raio atômico diminui da esquerda para a direita ao longo de um período e aumenta de cima para baixo em um grupo.
- Eletronegatividade aumenta da esquerda para a direita ao longo de um período e diminui de cima para baixo em um grupo.
- Energia de ionização tende a aumentar ao longo de um período e diminui ao descer um grupo.
Exemplo de Como Usar a Tabela Periódica
Para exemplificar, vamos olhar para dois elementos do grupo 17, os halogênios:
- Flúor (F): Número atômico 9, tem 7 elétrons na camada de valência. Ele é altamente reativo devido à sua forte tendência de aceitar um elétron para completar sua camada de valência.
- Iodo (I): Número atômico 53, também possui 7 elétrons na camada de valência, mas como está em um período mais baixo, o seu raio atômico é maior, e sua eletronegatividade é menor que a do flúor. Isso faz com que o iodo seja menos reativo que o flúor.
A partir da tabela, podemos prever que o flúor será mais reativo do que o iodo, devido à sua maior eletronegatividade.
Fórmulas e Equações Relacionadas
Embora a Tabela Periódica não envolva diretamente muitas fórmulas matemáticas, ela é essencial para entender as propriedades químicas que influenciam as reações. Aqui estão algumas fórmulas importantes que envolvem conceitos relacionados à tabela:
- Lei de Coulomb (Interação Eletrostática):
Onde:F = k \cdot \frac{q_1 \cdot q_2}{r^2}- F é a força entre duas partículas carregadas,
- k é a constante eletrostática,
- q_1 e q_2 são as cargas das partículas,
- r é a distância entre elas.
- Equação da Energia de Ionização:
Onde:E = -13,6 \cdot \frac{Z^2}{n^2} \, \text{eV}- E é a energia de ionização do átomo,
- Z é o número atômico do elemento,
- n é o número da camada onde o elétron está.
Exemplos de Aplicações Práticas da Tabela Periódica
- Química Orgânica e Medicinal: A Tabela Periódica é crucial para a síntese de medicamentos, já que a combinação de elementos de grupos específicos pode levar à formação de substâncias com propriedades desejadas. Por exemplo, os compostos de carbono, hidrogênio, oxigênio e nitrogênio são a base da química orgânica e são amplamente utilizados em medicamentos.
- Tecnologia de Materiais: O entendimento dos metais e semimetais na Tabela Periódica permite a fabricação de novos materiais para eletrônicos, como semicondutores. Elementos como silício e germânio são fundamentais para a construção de chips de computador.
- Indústria Nuclear: A Tabela Periódica é essencial para o estudo e controle de reações nucleares. Elementos como urânio e plutônio são usados como combustível em usinas nucleares e em armamentos.
Conclusão
A Tabela Periódica é uma das ferramentas mais importantes na ciência química. Sua organização sistemática dos elementos químicos permite não apenas classificar os elementos com base em suas propriedades, mas também prever suas reações e comportamentos. A tabela proporciona uma base sólida para o estudo de muitas áreas da ciência, desde a química orgânica até a física nuclear, e suas aplicações práticas impactam diretamente diversos setores, como saúde, tecnologia, indústria e energia. O conhecimento da Tabela Periódica é essencial para qualquer estudante de ciências e para profissionais que trabalham em áreas técnicas e científicas.