Reações Químicas: Tipos e Equações Balanciadas
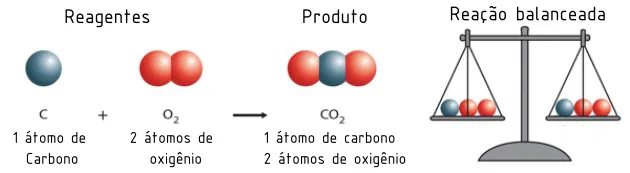
As reações químicas são processos nos quais uma ou mais substâncias (os reagentes) se transformam em novas substâncias (os produtos). Durante uma reação química, ocorrem rearranjos nas ligações entre os átomos, resultando em novas substâncias com propriedades diferentes das substâncias iniciais. As reações químicas são fundamentais para entender muitos processos que ocorrem na natureza, na indústria, no corpo humano, entre outros.
Principais Conceitos
1. Reagentes e Produtos
Reagentes: Substâncias que participam da reação química, sendo transformadas ao longo do processo.
Produtos: Novas substâncias formadas como resultado da reação química.
2. Equações Químicas
As equações químicas representam de forma simbólica o que ocorre em uma reação. Elas expressam a transformação dos reagentes em produtos, com a mesma quantidade de átomos de cada elemento, obedecendo à Lei da Conservação da Massa.
Equação química balanceada: Deve ter o mesmo número de átomos de cada elemento nos dois lados da equação, garantindo que a massa total se conserve.
3. Lei da Conservação da Massa
Essa lei, proposta por Antoine Lavoisier, afirma que a massa total dos reagentes é igual à massa total dos produtos em uma reação química. Ou seja, a quantidade de átomos de cada elemento antes e depois da reação permanece a mesma.
4. Balanceamento de Equações Químicas
O balanceamento de uma equação química envolve ajustar os coeficientes das substâncias participantes, para que o número de átomos de cada elemento seja igual nos dois lados da equação. Esse processo é essencial para refletir a conservação da massa.
Tipos de Reações Químicas
1. Reação de Síntese (ou Adição)
Nesta reação, dois ou mais reagentes se combinam para formar um único produto.
Exemplo:
2H2 (g) + O2 (g) → 2H2O (l)Essa equação mostra a formação da água a partir do hidrogênio e do oxigênio.
2. Reação de Decomposição
Uma única substância se decompõe em dois ou mais produtos.
Exemplo:
2H2O2 (l) → 2H2O (l) + O2 (g)A decomposição do peróxido de hidrogênio forma água e oxigênio.
3. Reação de Deslocamento Simples
Um elemento desloca outro em um composto, formando um novo composto e liberando um elemento.
Exemplo:
Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)O zinco desloca o cobre do sulfato de cobre, formando sulfato de zinco e liberando cobre metálico.
4. Reação de Duplo Deslocamento (ou Precipitação)
Os íons de dois compostos trocam de lugar, formando novos compostos, que podem ser sólidos (precipitado) ou gasosos.
Exemplo:
AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3 (aq)Nessa reação, o cloreto de prata (AgCl) é precipitado.
5. Reação de Combustão
Ocorre quando uma substância, normalmente um hidrocarboneto, reage com o oxigênio do ar, liberando energia, geralmente na forma de calor e luz.
Exemplo:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g)A combustão do metano (principal componente do gás natural) forma dióxido de carbono e água.
6. Reação Ácido-Base
Uma reação entre um ácido e uma base, que resulta na formação de água e um sal.
Exemplo:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)O ácido clorídrico reage com a base hidróxido de sódio, formando o sal cloreto de sódio e água.
Exemplos de Aplicação Prática
- Indústria Química: As reações de síntese e decomposição são amplamente utilizadas para produzir produtos químicos essenciais, como plásticos, fertilizantes e medicamentos.
- Bioquímica: As reações químicas são fundamentais em processos biológicos, como a respiração celular, onde glicose e oxigênio são convertidos em dióxido de carbono, água e energia.
- Tecnologia: Reações de combustão são utilizadas em motores de carros, usinas de energia, e outros dispositivos que geram energia.
- Tratamento de Águas: Reações ácido-base e de precipitação são utilizadas para purificar e tratar a água, removendo impurezas.
Balanceamento de Equações Químicas
Para balancear uma equação química, seguimos alguns passos:
- Escrever a equação não balanceada.
- Balancear os elementos que aparecem em mais de um composto, ajustando os coeficientes.
- Balancear os elementos que aparecem em apenas um composto de cada lado.
- Verificar se todos os elementos estão balanceados.
Exemplo: Para balancear a equação da combustão do metano:
CH4 (g) + O2 (g) → CO2 (g) + H2O (g)Passos:
- Balancear o carbono (C): já está balanceado, com 1 átomo de C de cada lado.
- Balancear o hidrogênio (H): há 4 átomos de H no metano, então precisamos de 2 moléculas de H₂O no lado dos produtos.
- Balancear o oxigênio (O): agora temos 2 átomos de oxigênio em cada molécula de CO₂ e 2 átomos em cada molécula de H₂O. No total, são 2 (do CO₂) + 2 (das H₂O) = 4 átomos de oxigênio. Portanto, precisamos de 2 moléculas de O₂ no lado dos reagentes.
Equação balanceada:
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g)Conclusão
As reações químicas desempenham um papel fundamental em muitos processos naturais e industriais, sendo essenciais para a formação de novos materiais e para o funcionamento de sistemas biológicos e tecnológicos. O estudo e o entendimento das reações químicas, bem como o balanceamento adequado das equações químicas, são indispensáveis para a previsibilidade de resultados e a eficiência em diversas áreas, como a indústria química, a medicina, a bioquímica e a engenharia. O domínio do tema permite que se otimizem processos, se desenvolvam novos produtos e se resolvam problemas práticos de forma eficaz e sustentável.