QUIMICA ENEM – TABELA PERIÓDICA
A Tabela Periódica
Introdução
A tabela periódica é um dos instrumentos mais importantes na química, proporcionando uma organização sistemática dos elementos com base em suas propriedades químicas e físicas. Este artigo explora a história, a estrutura, as propriedades e as tendências dos elementos na tabela periódica, além de suas aplicações práticas.
História da Tabela Periódica
Antecedentes
Antes da criação da tabela periódica, os cientistas já conheciam alguns elementos, mas não havia uma forma sistemática de organizá-los. Antoine Lavoisier, em 1789, foi um dos primeiros a listar elementos conhecidos, classificando-os em metais e não metais.
Desenvolvimento de Mendeleev
Em 1869, o químico russo Dmitri Mendeleev desenvolveu a primeira versão da tabela periódica. Ele organizou os elementos em ordem crescente de massa atômica e observou que as propriedades químicas se repetiam periodicamente. Mendeleev também deixou espaços vazios para elementos ainda não descobertos, prevendo suas propriedades com notável precisão.
Modernização da Tabela
Com a descoberta do próton e do número atômico por Henry Moseley em 1913, a tabela periódica foi reorganizada em ordem crescente de número atômico, corrigindo algumas inconsistências nas previsões de Mendeleev. Desde então, a tabela periódica tem sido expandida e atualizada com a descoberta de novos elementos.
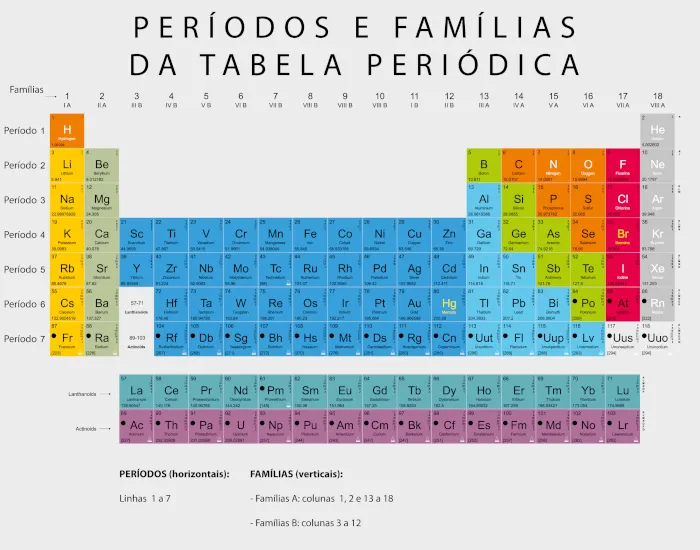
Estrutura da Tabela Periódica
A tabela periódica moderna é organizada em filas horizontais chamadas períodos e colunas verticais chamadas grupos ou famílias.
Períodos
Os períodos representam os níveis de energia dos elétrons de valência dos átomos. Há atualmente sete períodos na tabela periódica.
Grupos
Os grupos contêm elementos com propriedades químicas semelhantes, devido à configuração eletrônica semelhante de seus elétrons de valência. Existem 18 grupos na tabela periódica moderna.
Blocos
A tabela periódica pode ser dividida em blocos com base na subcamada de preenchimento final de elétrons:
- Bloco s: Grupos 1 e 2, mais o hidrogênio e o hélio.
- Bloco p: Grupos 13 a 18.
- Bloco d: Grupos 3 a 12, os elementos de transição.
- Bloco f: Lantanídeos e actinídeos, localizados abaixo do corpo principal da tabela.
Classificação dos Elementos
Metais
Os metais são elementos que conduzem bem a eletricidade e o calor, são maleáveis e dúcteis, e geralmente têm brilho metálico. Eles ocupam a maior parte da tabela periódica, incluindo todos os elementos dos blocos s, d e f, e alguns do bloco p.
Não-Metais
Os não-metais são elementos com propriedades opostas aos metais. Eles são isolantes ou maus condutores de eletricidade e calor e não são maleáveis nem dúcteis. Eles estão localizados no lado direito da tabela periódica (bloco p).
Metaloides
Os metaloides possuem propriedades intermediárias entre metais e não-metais. Eles são encontrados em uma linha de transição entre os metais e os não-metais, geralmente na forma de uma escadinha diagonal.
Tendências Periódicas
Raio Atômico
O raio atômico é a distância entre o núcleo de um átomo e seu elétron mais externo. Este diminui ao longo de um período da esquerda para a direita, devido ao aumento da carga nuclear efetiva. Aumenta de cima para baixo em um grupo, devido ao aumento do número de camadas de elétrons.
Energia de Ionização
A energia de ionização é a energia necessária para remover um elétron de um átomo no estado gasoso. Esta aumenta ao longo de um período da esquerda para a direita e diminui de cima para baixo em um grupo.
Eletronegatividade
A eletronegatividade é a tendência de um átomo atrair elétrons em uma ligação química. Esta aumenta ao longo de um período da esquerda para a direita e diminui de cima para baixo em um grupo. O flúor é o elemento mais eletronegativo.
Afinidade Eletrônica
A afinidade eletrônica é a energia liberada quando um átomo no estado gasoso ganha um elétron. De forma geral, esta aumenta ao longo de um período da esquerda para a direita e pode variar dentro de um grupo.
Aplicações da Tabela Periódica
Química Analítica
A tabela periódica é essencial na química analítica para identificar elementos e prever produtos de reações químicas.
Engenharia de Materiais
Os engenheiros de materiais utilizam a tabela periódica para desenvolver novos materiais com propriedades específicas, como ligas metálicas, semicondutores e supercondutores.
Medicina
Elementos específicos e suas propriedades são utilizados em diagnósticos médicos (como raios-X) e tratamentos (como radioterapia).
Educação
A tabela periódica é uma ferramenta fundamental no ensino da química, ajudando os estudantes a compreenderem as propriedades dos elementos e suas reações.
Conclusão
A tabela periódica é um recurso inestimável na química e nas ciências em geral, organizando os elementos de maneira que suas propriedades e tendências sejam facilmente compreendidas. Desde suas origens com Mendeleev até sua forma moderna, a tabela periódica continua a evoluir com a descoberta de novos elementos e a aprofundar nosso entendimento da matéria.
Referências
- Atkins, P., & de Paula, J. (2014). “Atkins’ Physical Chemistry.” Oxford University Press.
- Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C. J., & Woodward, P. (2018). “Chemistry: The Central Science.” Pearson.
- Chang, R., & Goldsby, K. (2016). “Chemistry.” McGraw-Hill Education.
- Zumdahl, S. S., & Zumdahl, S. A. (2014). “Chemistry.” Cengage Learning.
- Silberberg, M. S. (2017). “Principles of General Chemistry.” McGraw-Hill Education.
ACESSE SUA TABELA: