Química ENEM – Número Atômico, Massa Atômica, Íons e Isótopos
Introdução
A química moderna baseia-se no entendimento profundo da estrutura atômica e das propriedades dos átomos. Entre os conceitos fundamentais estão o número atômico, a massa atômica, os íons e os isótopos. Este artigo oferece uma explicação detalhada de cada um desses conceitos, sua importância e aplicações práticas.
Número Atômico
O número atômico (Z) de um elemento químico é o número de prótons presentes no núcleo de um átomo desse elemento. Este número é único para cada elemento e determina sua identidade química.
Símbolo: Z
Exemplo: O número atômico do hidrogênio é 1, o do carbono é 6, e o do oxigênio é 8.
Importância do Número Atômico
- Identidade do Elemento: Define o elemento químico.
- Posição na Tabela Periódica: Os elementos são organizados na tabela periódica em ordem crescente de número atômico.
- Propriedades Químicas: Influencia as propriedades químicas e a reatividade do elemento.
Massa Atômica
A massa atômica (A) de um átomo é a massa total de seus prótons e nêutrons. Como os elétrons têm massa negligível, eles não são considerados no cálculo da massa atômica.
Símbolo: A
Cálculo: A = Z + N (onde N é o número de nêutrons)
Unidades de Massa Atômica
A massa atômica é geralmente expressa em unidades de massa atômica (u), onde 1 u é definida como um doze avos da massa de um átomo de carbono-12.
Massa Atômica Relativa
A massa atômica relativa de um elemento é a média ponderada das massas atômicas de todos os isótopos naturais desse elemento, considerando suas abundâncias relativas.
Exemplo: A massa atômica relativa do cloro é aproximadamente 35,5 u, refletindo a média ponderada dos isótopos cloro-35 e cloro-37.
Íons
Íons são átomos ou moléculas que ganharam ou perderam um ou mais elétrons, adquirindo uma carga elétrica.
Cátions e Ânions
- Cátions: Íons com carga positiva (perda de elétrons).
Exemplo: Na+ (sódio perdeu um elétron). - Ânions: Íons com carga negativa (ganho de elétrons).
Exemplo: Cl– (cloro ganhou um elétron).
Formação de Íons
- Perda de Elétrons: Forma cátions.
Exemplo: Na → Na+ + e– - Ganho de Elétrons: Forma ânions.
Exemplo: Cl + e– → Cl–
Importância dos Íons
- Reatividade Química: Íons são altamente reativos e formam compostos iônicos.
- Funções Biológicas: Essenciais para processos biológicos, como a condução de impulsos nervosos e o equilíbrio de fluidos.
- Propriedades Físicas: Determinam propriedades como a condutividade elétrica e a solubilidade.
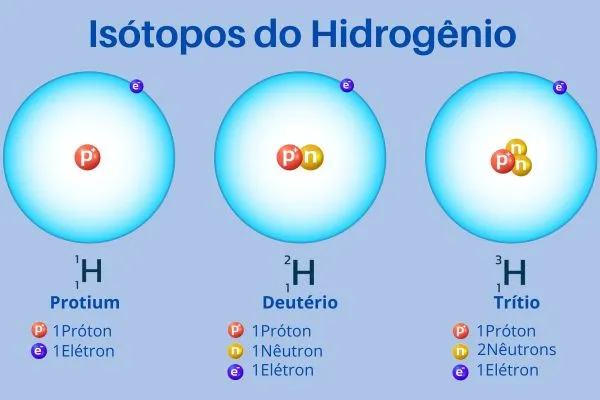
Isótopos
Isótopos são átomos do mesmo elemento que possuem o mesmo número atômico (número de prótons) mas diferentes números de nêutrons, resultando em diferentes massas atômicas.
Exemplo: Carbono-12 (12C) e Carbono-14 (14C) são isótopos do carbono.
Representação de Isótopos
Isótopos são representados pelo símbolo do elemento seguido pelo número de massa:
Exemplo: 12C, 14C
Tipos de Isótopos
- Isótopos Estáveis: Não sofrem decaimento radioativo.
Exemplo: 12C, 13C - Isótopos Radioativos: Sofrem decaimento radioativo, emitindo radiação.
Exemplo: 14C, 131I
Importância dos Isótopos
- Datação Radiométrica: Utilizada para determinar a idade de materiais antigos (ex.: datação por carbono-14).
- Medicina: Usados em diagnósticos e tratamentos (ex.: iodo-131 no tratamento de câncer de tireoide).
- Pesquisa Científica: Ajudam na compreensão de processos químicos e biológicos.
Aplicações Práticas
1. Medicina
- Diagnóstico: Isótopos radioativos são usados em exames de imagem, como a tomografia por emissão de pósitrons (PET).
- Tratamento: Terapia com radioisótopos para tratamento de câncer.
2. Indústria
- Rastreamento: Isótopos são usados para rastrear processos industriais e detectar vazamentos.
- Controle de Qualidade: Determinação da composição de materiais.
3. Meio Ambiente
- Estudos Climáticos: Análise de isótopos em gelo e sedimentos para estudar mudanças climáticas.
- Poluição: Monitoramento de poluentes ambientais.
Conclusão
Compreender os conceitos de número atômico, massa atômica, íons e isótopos é fundamental para a química e suas aplicações. Esses conceitos não apenas ajudam a definir a identidade e as propriedades dos elementos, mas também desempenham um papel crucial em diversas áreas, desde a medicina até a pesquisa ambiental. O estudo desses aspectos da química continua a proporcionar insights valiosos sobre o mundo ao nosso redor e as interações fundamentais que sustentam a matéria.
Referências
- Atkins, P., & de Paula, J. (2014). Atkins’ Physical Chemistry. Oxford University Press.
- Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C. J., & Woodward, P. (2018). Chemistry: The Central Science. Pearson.
- Chang, R., & Goldsby, K. (2016). Chemistry. McGraw-Hill Education.
- Zumdahl, S. S., & Zumdahl, S. A. (2014). Chemistry. Cengage Learning.
- Silberberg, M. S. (2017). Principles of General Chemistry. McGraw-Hill Education.