Configuração Eletrônica: Um Guia Completo
Introdução
A configuração eletrônica de um átomo descreve a distribuição dos elétrons em orbitais ao redor do núcleo. Esse conceito é fundamental para entender as propriedades químicas e físicas dos elementos e suas interações.
Princípios Básicos da Configuração Eletrônica
Estrutura Atômica
Os átomos são compostos por um núcleo contendo prótons e nêutrons, rodeado por elétrons que ocupam regiões específicas chamadas orbitais.
Princípio da Construção (Aufbau)
Os elétrons preenchem os orbitais em ordem crescente de energia, seguindo o princípio de Aufbau.
Princípio da Exclusão de Pauli
Um orbital pode acomodar no máximo dois elétrons com spins opostos.
Regra de Hund
Elétrons ocupam orbitais vazios antes de emparelharem.
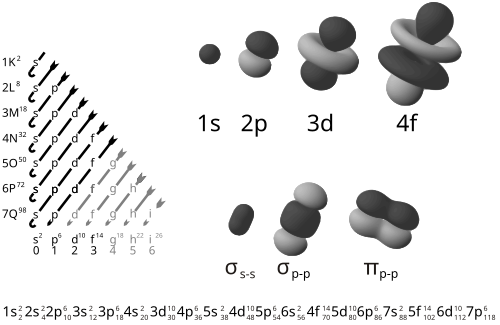
Notação de Configuração Eletrônica
Representada na forma espectroscópica:
nℓx onde:
- n: Número quântico principal.
- ℓ: Tipo de orbital (s, p, d, f).
- x: Número de elétrons no orbital.
Exemplo: Oxigênio (Z=8): 1s² 2s² 2p⁴
Configuração Eletrônica dos Primeiros 10 Elementos
| Elemento | Símbolo | Configuração Eletrônica |
|---|---|---|
| Hidrogênio | H | 1s¹ |
| Hélio | He | 1s² |
| Lítio | Li | 1s² 2s¹ |
| Berílio | Be | 1s² 2s² |
| Boro | B | 1s² 2s² 2p¹ |
| Carbono | C | 1s² 2s² 2p² |
| Nitrogênio | N | 1s² 2s² 2p³ |
| Oxigênio | O | 1s² 2s² 2p⁴ |
| Flúor | F | 1s² 2s² 2p⁵ |
| Neônio | Ne | 1s² 2s² 2p⁶ |
Configuração Eletrônica e Propriedades Químicas
A configuração eletrônica determina as propriedades químicas dos elementos.
Exemplo: Gases Nobres
Os gases nobres possuem camadas eletrônicas completas, tornando-os quimicamente inertes.
Íons e Configurações Eletrônicas
Quando átomos ganham ou perdem elétrons, suas configurações eletrônicas mudam.
Exemplo:
- Sódio (Na): 1s² 2s² 2p⁶ 3s¹
- Íon Sódio (Na⁺): 1s² 2s² 2p⁶
Aplicações das Configurações Eletrônicas
- Espectroscopia: Análise de materiais através da absorção e emissão de luz.
- Química Medicinal: Desenvolvimento de medicamentos com base nas interações eletrônicas.
- Ciência dos Materiais: Determinação das propriedades dos elementos na engenharia.
Conclusão
A configuração eletrônica é fundamental para compreender as propriedades dos elementos e suas aplicações na ciência e tecnologia.
Referências
- Atkins, P., & de Paula, J. (2014). “Atkins’ Physical Chemistry.” Oxford University Press.
- Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C. J., & Woodward, P. (2018). “Chemistry: The Central Science.” Pearson.
- Chang, R., & Goldsby, K. (2016). “Chemistry.” McGraw-Hill Education.
- Zumdahl, S. S., & Zumdahl, S. A. (2014). “Chemistry.” Cengage Learning.
- Silberberg, M. S. (2017). “Principles of General Chemistry.” McGraw-Hill Education.