Ligação Covalente: Natureza, Teorias e Aplicações
Resumo
A ligação covalente envolve o compartilhamento de pares de elétrons entre átomos, permitindo que eles alcancem estabilidade eletrônica. Este artigo explora a natureza da ligação covalente, sua classificação em simples, dupla e tripla, além das teorias que explicam sua formação, como a Teoria do Orbital Molecular (TOM) e a Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (VSEPR). Também discutimos as propriedades dos compostos covalentes e suas aplicações na química, biologia e indústria.
Introdução
A ligação covalente ocorre quando dois átomos compartilham pares de elétrons, diferindo da ligação iônica, na qual há transferência de elétrons. Esse conceito foi introduzido por Gilbert N. Lewis em 1916, que propôs que os átomos formam ligações para alcançar a configuração eletrônica de um gás nobre.
Desde moléculas simples, como O₂ e H₂O, até estruturas complexas como o DNA, a ligação covalente desempenha um papel crucial na química. Este artigo examina os fundamentos dessa ligação e suas implicações em diversas áreas.
Teoria da Ligação Covalente
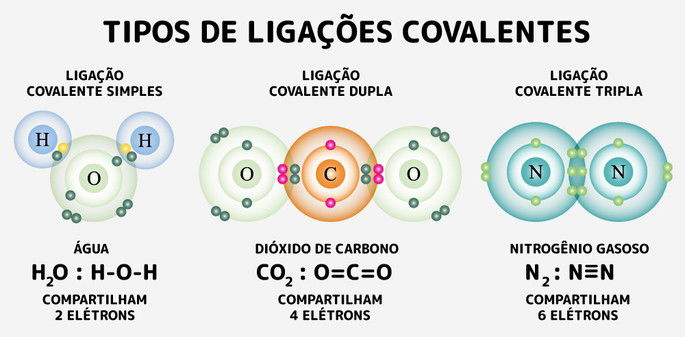
Segundo o modelo de Lewis, átomos com eletronegatividades semelhantes compartilham elétrons para atingir estabilidade eletrônica. Esse compartilhamento pode resultar em ligações:
- Simples – Compartilha um par de elétrons (ex: H₂).
- Dupla – Compartilha dois pares de elétrons (ex: O₂).
- Tripla – Compartilha três pares de elétrons (ex: N₂).
Ligações duplas e triplas são mais fortes e curtas, influenciando a geometria molecular e a rigidez das moléculas.
Estruturas de Lewis
As estruturas de Lewis são representações gráficas das ligações covalentes, onde os elétrons de valência aparecem como pontos ao redor dos átomos. Na molécula de água (H₂O), por exemplo, o oxigênio compartilha pares de elétrons com dois átomos de hidrogênio, formando ligações covalentes simples.
Essa representação auxilia na previsão da polaridade molecular, essencial para compreender interações intermoleculares e propriedades físicas das substâncias.
Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (VSEPR)
A Teoria VSEPR, proposta por Gillespie e Nyholm (1957), prevê a geometria molecular com base na repulsão entre pares de elétrons ao redor do átomo central. Algumas geometrias comuns incluem:
- Linear – CO₂
- Trigonal plana – BF₃
- Tetraédrica – CH₄
- Trigonal piramidal – NH₃
- Angular – H₂O
Teoria do Orbital Molecular (TOM)
A Teoria do Orbital Molecular (TOM) explica que, na formação de ligações covalentes, os elétrons não pertencem mais a átomos individuais, mas a orbitais moleculares que abrangem toda a molécula. Existem dois tipos principais:
- Orbitais ligantes – Estabilizam a molécula.
- Orbitais antiligantes – Destabilizam a molécula.
A TOM também explica ligações covalentes dativas, como no íon amônio (NH₄⁺), onde um átomo doa um par de elétrons completos.
Propriedades dos Compostos Covalentes
- Pontos de fusão e ebulição baixos – Exceto em redes covalentes, como o diamante.
- Solubilidade – Compostos polares dissolvem-se em água, enquanto apolares são solúveis em solventes orgânicos.
- Não conduzem eletricidade – Exceto substâncias como o grafite, que possui elétrons delocalizados.
- Flexibilidade e rigidez – Variam de gases como O₂ a sólidos duros como o diamante.
Aplicações dos Compostos Covalentes
A ligação covalente tem aplicações em diversas áreas:
- Materiais avançados – Grafeno e diamante são usados em tecnologia e indústria.
- Biomoléculas – DNA, proteínas e carboidratos dependem da ligação covalente para sua estrutura.
- Polímeros – São a base de plásticos e fibras sintéticas.
- Química ambiental – CO₂ e outros compostos covalentes desempenham papéis no aquecimento global.
Avanços na Ligação Covalente
Pesquisas modernas em química computacional e Teoria do Funcional da Densidade (DFT) têm permitido modelar com precisão ligações covalentes. Esses avanços são fundamentais para o desenvolvimento de novos materiais e fármacos.
Conclusão
A ligação covalente é uma interação química essencial, presente em substâncias fundamentais para a vida e a tecnologia. Desde pequenas moléculas como H₂O até polímeros complexos, o entendimento dessa ligação possibilita inovações na química e na indústria.