Ligações Químicas: Como os Átomos se Combinam
Introdução
As ligações químicas são interações entre átomos que permitem a formação de moléculas e compostos. Estas ligações são essenciais para a formação de todos os materiais e substâncias no universo, desde os compostos mais simples, como a água (H₂O), até os compostos mais complexos, como as proteínas e o DNA. A compreensão das ligações químicas é fundamental para entender como a matéria se organiza e reage nas diferentes condições físicas e químicas. Existem diferentes tipos de ligações químicas, que variam conforme a forma como os átomos interagem, e cada uma delas apresenta características específicas que influenciam as propriedades das substâncias formadas.
1. Ligações Iônicas
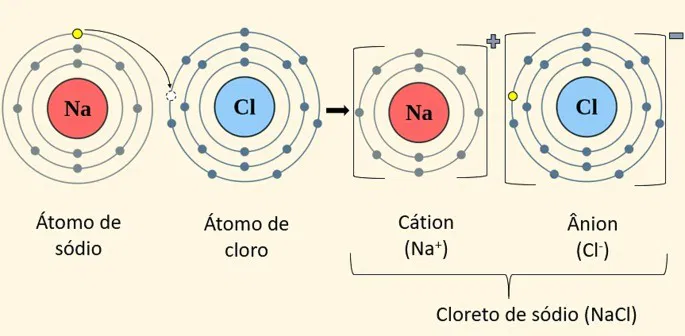
As ligações iônicas ocorrem entre átomos de elementos com grande diferença de eletronegatividade. Em uma ligação iônica, um átomo doa um ou mais elétrons para outro átomo, resultando na formação de íons de cargas opostas, que se atraem devido à força eletrostática.
- Exemplo típico: A formação do cloreto de sódio (NaCl). O sódio (Na) doa um elétron para o cloro (Cl), formando o íon sódio (Na⁺) e o íon cloreto (Cl⁻). Esses íons se atraem fortemente e formam uma rede cristalina.
- Propriedades:
- Altos pontos de fusão e ebulição.
- Solúveis em água.
- Conduzem eletricidade quando dissolvidos em água ou fundidos.
- Equação de formação:
Na → Na⁺ + e⁻Cl + e⁻ → Cl⁻
2. Ligações Covalentes
As ligações covalentes ocorrem quando dois átomos compartilham um ou mais pares de elétrons. Diferente da ligação iônica, não há transferência de elétrons, mas sim o compartilhamento, o que resulta na formação de moléculas.
- Exemplo típico: A formação da molécula de hidrogênio (H₂). Cada átomo de hidrogênio compartilha seu único elétron com outro átomo de hidrogênio, formando uma ligação covalente simples.
- Propriedades:
- Baixos pontos de fusão e ebulição (geralmente).
- Não conduzem eletricidade.
- Podem ser polares ou apolares, dependendo da diferença de eletronegatividade entre os átomos envolvidos.
- Exemplo de fórmula: Para a formação da molécula de H₂:
H + H → H₂
3. Ligações Metálicas
As ligações metálicas ocorrem entre átomos de metais. Nessa ligação, os elétrons da camada de valência são compartilhados livremente entre todos os átomos do metal, formando uma “nuvem” de elétrons deslocalizados que se movem livremente.
- Exemplo típico: O cobre (Cu) e o ferro (Fe) são bons exemplos de metais que formam ligações metálicas. Os átomos de cobre ou ferro compartilham seus elétrons de valência, criando uma rede de elétrons que dá ao metal suas propriedades características.
- Propriedades:
- Boa condutividade elétrica e térmica.
- Maleabilidade e ductilidade (podem ser moldados sem quebrar).
- Brilho metálico.
- Equação simbólica: Não é possível escrever uma equação química simples para a ligação metálica, pois ela envolve uma rede de átomos de metal e elétrons deslocalizados.
4. Ligações de Hidrogênio
Embora não seja uma ligação verdadeira, as ligações de hidrogênio são interações importantes em muitos compostos, especialmente em moléculas biológicas. Elas ocorrem quando o átomo de hidrogênio, ligado a um átomo muito eletronegativo (como oxigênio ou nitrogênio), se aproxima de um átomo eletronegativo em outra molécula.
- Exemplo típico: Na água (H₂O), as moléculas de água formam ligações de hidrogênio entre os átomos de hidrogênio de uma molécula e os átomos de oxigênio de outra molécula.
- Propriedades:
- Conferem alta coesão e adesão em líquidos.
- São responsáveis pela alta temperatura de ebulição da água.
- Equação simbólica: Não existe uma equação simples para as ligações de hidrogênio, mas elas podem ser representadas simbolicamente como interações entre os átomos de hidrogênio e os átomos eletronegativos, como no caso da água.
Exemplos de Aplicações Práticas das Ligações Químicas
- Água e suas propriedades: A água é um excelente exemplo de como a formação de ligações de hidrogênio resulta em propriedades únicas. As ligações de hidrogênio entre as moléculas de água conferem a ela uma alta temperatura de ebulição, alta tensão superficial e grande capacidade calorífica. Isso é essencial para a regulação térmica em sistemas biológicos e para a estabilidade do clima na Terra.
- Sais e seus usos: A formação de ligações iônicas entre cátions e ânions resulta em compostos como o sal de cozinha (NaCl), que têm diversas aplicações no cotidiano, desde a culinária até processos industriais.
- Materiais metálicos: As ligações metálicas conferem propriedades como condutividade elétrica e maleabilidade a materiais como o cobre e o alumínio, que são amplamente usados na fabricação de fios elétricos e estruturas metálicas.
- Medicamentos e biomoléculas: As ligações covalentes e as ligações de hidrogênio são fundamentais para a formação de biomoléculas como proteínas, ácidos nucleicos (DNA/RNA) e carboidratos, que são essenciais para a vida. O entendimento das ligações químicas nessas moléculas permite o desenvolvimento de medicamentos e terapias genéticas.
Conclusão
As ligações químicas são a base da química, pois determinam como os átomos se combinam para formar moléculas e substâncias. A compreensão dos diferentes tipos de ligações — iônicas, covalentes, metálicas e de hidrogênio — é fundamental para explicar as propriedades dos materiais, suas reações e sua aplicabilidade no cotidiano. Desde os compostos mais simples até as biomoléculas complexas, as ligações químicas desempenham um papel crucial em uma variedade de processos naturais e tecnológicos. Estudar as ligações químicas nos ajuda a compreender a estrutura da matéria e a desenvolver novos materiais e medicamentos que têm um impacto significativo em muitas áreas da ciência e da vida diária.