Primeira e Segunda Leis da Termodinâmica: Fundamentos e Aplicações
Introdução
A termodinâmica é a área da física que estuda as transformações de energia, especialmente o calor, e como ele pode ser convertido em trabalho mecânico. Duas leis fundamentais da termodinâmica, a Primeira e a Segunda Leis, têm uma aplicação profunda tanto em processos naturais quanto em dispositivos tecnológicos, como motores e refrigeradores. Estas leis não apenas explicam a conservação de energia, mas também impõem limites à eficiência desses processos. Neste artigo, abordaremos o que são essas leis, suas implicações e exemplos práticos de sua aplicação.
1. Primeira Lei da Termodinâmica
A Primeira Lei da Termodinâmica é, basicamente, a lei da conservação de energia aplicada a sistemas termodinâmicos. Ela afirma que a energia total de um sistema isolado é constante. Ou seja, a energia não pode ser criada nem destruída; ela apenas se transforma de uma forma para outra.
1.1. Formulação Matemática
A Primeira Lei pode ser expressa pela seguinte equação:
ΔU = Q – W
Onde:
- ΔU é a variação da energia interna do sistema.
- Q é a quantidade de calor trocada pelo sistema.
- W é o trabalho realizado pelo sistema (no caso de um trabalho realizado pelo sistema, W será positivo).
1.2. Significado da Primeira Lei
A energia interna de um sistema depende da sua temperatura e do tipo de substância que o constitui. Quando um sistema recebe calor (Q), sua energia interna aumenta. Se o sistema realiza trabalho (W) sobre o ambiente, sua energia interna diminui. Isso implica que a quantidade de energia trocada entre o sistema e seus arredores pode ser representada pela diferença entre o calor recebido e o trabalho realizado.
1.3. Exemplos Práticos
- Motor a combustão: Em um motor de carro, o combustível queima, liberando calor. Parte desse calor é convertido em trabalho mecânico para mover o veículo, enquanto outra parte é dissipada como calor.
- Refrigeradores: Em um refrigerador, o trabalho realizado pela máquina de compressão permite que o calor seja retirado do interior do aparelho e transferido para o ambiente, mantendo o conteúdo refrigerado.
2. Segunda Lei da Termodinâmica
A Segunda Lei da Termodinâmica descreve a irreversibilidade dos processos naturais. Ela estabelece que a entropia de um sistema isolado sempre tende a aumentar ao longo do tempo. A entropia pode ser entendida como uma medida do grau de desordem ou aleatoriedade de um sistema. Em termos simples, a Segunda Lei diz que o calor flui de regiões de maior temperatura para regiões de menor temperatura, e não o contrário, sem que se faça trabalho adicional.
2.1. Formulação Matemática
A Segunda Lei também pode ser expressa em termos de entropia. A variação da entropia (ΔS) em um processo é dada por:
ΔS ≥ Q/T
Onde:
- ΔS é a variação da entropia do sistema.
- Q é o calor trocado.
- T é a temperatura em Kelvin.
2.2. Consequências da Segunda Lei
A Segunda Lei da Termodinâmica tem várias implicações importantes:
- Impossibilidade de máquinas térmicas 100% eficientes: Nenhuma máquina pode converter toda a energia térmica em trabalho útil. Sempre haverá uma parte da energia dissipada como calor, o que significa que não podemos ter uma máquina que funcione como uma “perpétua móvel” (máquina que funcione sem a necessidade de fornecer energia externa).
- Aumento da Entropia: A entropia de um sistema isolado sempre aumenta ou permanece constante, nunca diminui. Isso significa que, à medida que os processos ocorrem, a energia tende a se dispersar e os sistemas tornam-se mais desordenados.
2.3. Exemplos Práticos
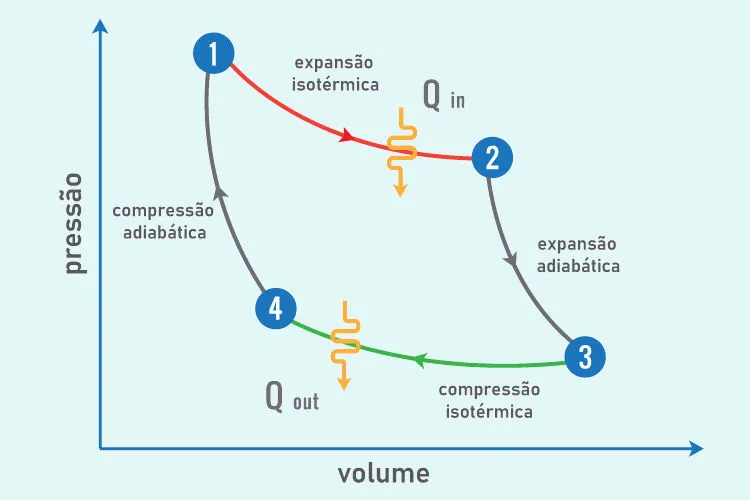
- Ciclos de calor: Em um ciclo termodinâmico, como o ciclo de Carnot (um ciclo idealizado de um motor térmico), a maior parte do calor fornecido não pode ser convertida em trabalho útil, devido à presença de entropia.
- Processos naturais: Quando um bloco de gelo derrete em uma sala quente, o calor flui do ambiente para o gelo, causando um aumento na entropia do sistema, uma vez que a água líquida tem mais liberdade molecular do que o gelo.
3. Comparação entre a Primeira e a Segunda Lei
- Primeira Lei: Foca na conservação da energia. Ela afirma que a energia total do sistema é constante e pode ser transformada de uma forma para outra, mas não pode ser criada nem destruída.
- Segunda Lei: Foca na direção dos processos naturais. Ela impõe que os processos naturais não são reversíveis e que a entropia do sistema isolado tende a aumentar com o tempo.
4. Aplicações da Primeira e Segunda Lei
4.1. Máquinas Térmicas e Motores
A Primeira e a Segunda Lei são fundamentais para entender como os motores funcionam. Os motores convertendo calor em trabalho sempre enfrentam a limitação da Segunda Lei, o que impede que todo o calor gerado pela queima de combustíveis seja convertido em energia útil. Além disso, a Primeira Lei garante que, embora o trabalho seja realizado, a energia não é perdida, mas apenas transformada.
4.2. Refrigeradores e Ar-condicionados
Esses aparelhos funcionam basicamente pelo princípio da Segunda Lei. Eles retiram calor de um espaço frio (como o interior do refrigerador) e o transferem para um ambiente mais quente. Esse processo exige trabalho, geralmente realizado por um compressor que utiliza energia elétrica.
5. Conclusão
A Primeira e a Segunda Lei da Termodinâmica são fundamentais para a compreensão dos processos de conversão de energia e da natureza dos sistemas físicos. A Primeira Lei nos lembra que a energia não se perde, mas se transforma, enquanto a Segunda Lei estabelece que a eficiência desses processos nunca será 100%, devido à tendência natural de aumento da entropia. Esses conceitos são essenciais não apenas para a física, mas também para a engenharia, biologia e outras áreas que lidam com transformações de energia.
Referências
- GIESECKE, R. et al. Fisiologia Humana: Uma Abordagem Integrada. São Paulo: McGraw-Hill, 2011.
- RESNICK, R.; HALLIDAY, D. Fundamentos de Física. 9ª ed. Rio de Janeiro: LTC, 2003.
- YOUNG, H. D.; FREEDMAN, R. A. Fundamentals of Physics. 10ª ed. New York: Wiley, 2004.