Estrutura Atômica: Modelos e Evolução do Conceito
Introdução
A estrutura atômica é a base de muitos conceitos da química e física moderna. Ao longo da história, diferentes modelos atômicos foram propostos para descrever a composição da matéria. Cada modelo reflete o conhecimento disponível na época sobre a constituição do átomo, suas propriedades e o comportamento dos seus componentes. A evolução dos modelos atômicos é um exemplo fascinante de como a ciência progride ao longo do tempo, à medida que novas descobertas e tecnologias permitem uma melhor compreensão do mundo submicroscópico. Este artigo revisa os principais modelos atômicos propostos ao longo da história, desde a teoria de Dalton até os modelos contemporâneos baseados na mecânica quântica.
1. Modelo de Dalton (1803)
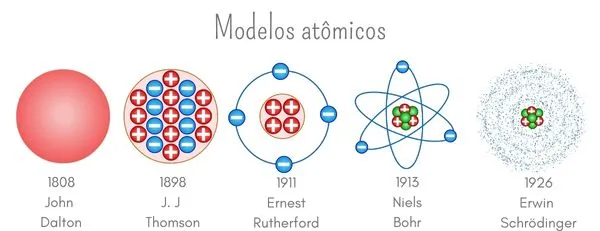
O modelo atômico proposto por John Dalton, no início do século XIX, foi o primeiro modelo científico da estrutura do átomo. Dalton baseou suas ideias em experimentos de gases e descobertas de relações químicas. Seu modelo era extremamente simples e postulava que a matéria era composta por partículas indivisíveis chamadas átomos.
- Postulados principais:
- Os átomos são as unidades básicas da matéria, indivisíveis e indestrutíveis.
- Os átomos de um mesmo elemento são idênticos em massa e propriedades.
- Em uma reação química, os átomos se rearranjam, mas não se transformam em átomos de outros elementos.
Embora o modelo de Dalton tenha sido útil para explicar as leis da combinação química, a ideia de átomos indivisíveis foi posteriormente revisada com o desenvolvimento dos modelos subsequentes.
2. Modelo de Thomson (1897)
O modelo de Thomson, conhecido como “pudim de passas”, foi proposto após a descoberta do elétron por J.J. Thomson em 1897. Thomson sugeriu que o átomo era uma esfera carregada positivamente, na qual os elétrons, de carga negativa, estavam distribuídos de maneira uniforme, como passas em um pudim. A proposta de Thomson ajudou a explicar a neutralidade do átomo.
- Postulado: O átomo é composto por uma esfera positiva, com partículas negativas (elétrons) distribuídas uniformemente por sua superfície.
Esse modelo não explicava completamente os fenômenos observados em experimentos posteriores, como a dispersão de partículas alfa, o que levou ao desenvolvimento de novos modelos.
3. Modelo de Rutherford (1911)
Ernest Rutherford, em 1911, propôs um novo modelo atômico após realizar um experimento em que partículas alfa foram disparadas contra uma lâmina fina de ouro. A observação de que algumas partículas alfa eram desviadas, e outras até mesmo refletidas, levou Rutherford a concluir que o átomo tem um núcleo pequeno, denso e positivamente carregado, rodeado por uma “nuvem” de elétrons.
- Postulados principais:
- O átomo possui um núcleo central pequeno e denso, com carga positiva.
- Os elétrons giram ao redor do núcleo em órbitas relativamente grandes, com bastante espaço vazio entre o núcleo e os elétrons.
Embora esse modelo fosse mais preciso do que os anteriores, ele não explicava como os elétrons conseguiam manter-se em órbitas estáveis, sem irradiar energia e colidir com o núcleo.
4. Modelo de Bohr (1913)
O modelo de Niels Bohr foi uma modificação do modelo de Rutherford e foi baseado na ideia de quantização da energia. Bohr propôs que os elétrons giram em órbitas circulares ao redor do núcleo, mas que só poderiam ocupar órbitas de energia fixa. Quando um elétron salta de uma órbita para outra, ele emite ou absorve uma quantidade específica de energia.
- Postulados principais:
- Os elétrons giram em órbitas circulares fixas, sem emitir radiação.
- A radiação é emitida ou absorvida quando um elétron salta entre essas órbitas.
- As órbitas são quantizadas e correspondem a níveis de energia discretos.
Esse modelo foi eficaz para explicar o espectro de emissão de hidrogênio, mas não conseguia explicar o comportamento de átomos mais complexos.
5. Modelo Quântico (1926 – presente)
O modelo atômico atual, baseado na mecânica quântica, foi desenvolvido após os trabalhos de figuras como Werner Heisenberg e Erwin Schrödinger. A teoria quântica introduziu a ideia de que não é possível determinar a posição exata de um elétron, mas apenas a probabilidade de encontrá-lo em uma região específica ao redor do núcleo. Essa probabilidade é descrita por orbitais, que são regiões no espaço onde a probabilidade de encontrar um elétron é maior.
- Postulados principais:
- Os elétrons não possuem órbitas fixas, mas são descritos por funções de onda (orbitais) que indicam a probabilidade de sua localização.
- As energias dos elétrons são quantizadas, mas os