LIGAÇÃO METÁLICA: Estrutura, Propriedades e Aplicações
Resumo
A ligação metálica é um tipo fundamental de interação química que ocorre entre átomos de metais, onde elétrons são compartilhados de maneira deslocalizada em uma rede tridimensional de cátions metálicos. Este artigo explora a natureza da ligação metálica, suas características estruturais e propriedades físicas, bem como suas diversas aplicações em materiais metálicos. São discutidas também as teorias que explicam a ligação metálica, como a Teoria do Mar de Elétrons e o Modelo de Bandas, além das implicações tecnológicas e industriais associadas aos metais.
Introdução
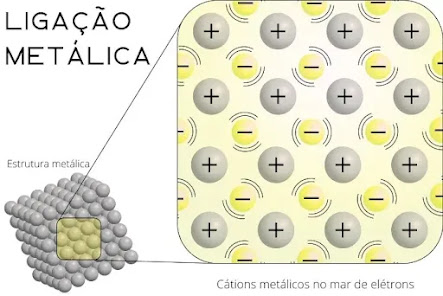
A ligação metálica é uma forma única de interação química que ocorre entre átomos de metais, caracterizada pela presença de um “mar de elétrons” deslocalizados que flui livremente ao redor de íons metálicos positivos. Esse tipo de ligação é responsável por muitas das propriedades físicas observadas nos metais, como condutividade elétrica e térmica, brilho e maleabilidade. Ao contrário das ligações covalentes e iônicas, a ligação metálica não envolve a formação de pares específicos de elétrons entre átomos, mas sim a delocalização de elétrons que se movem livremente dentro da estrutura metálica.
Teoria da Ligação Metálica
A Teoria do Mar de Elétrons, proposta por Sir Nevil Mott e John H. Van Vleck (1930s), é uma das principais teorias que explicam a natureza da ligação metálica. Segundo essa teoria, os átomos metálicos na estrutura sólida perdem seus elétrons de valência, que se tornam deslocalizados e formam um “mar” de elétrons que se movem livremente ao redor de cátions metálicos fixos. Essa deslocalização cria uma forte atração eletrostática entre os elétrons negativos e os cátions positivos, o que mantém o metal unido.
A Teoria do Modelo de Bandas é uma extensão dessa teoria, que explica a condutividade dos metais com base na formação de bandas de energia. Os orbitais atômicos dos átomos metálicos se sobrepõem, formando bandas de energia contínuas. Nos metais, essas bandas de energia se sobrepõem ou estão parcialmente preenchidas, permitindo que os elétrons se movam livremente e conduzam eletricidade. A diferença entre condutores, semicondutores e isolantes é determinada pela largura da banda de condução e pela largura do intervalo entre bandas.
Propriedades dos Metais
- Condutividade Elétrica e Térmica: A capacidade dos metais de conduzir eletricidade e calor é atribuída à presença de elétrons livres no “mar de elétrons”. Esses elétrons móveis transportam carga elétrica e energia térmica de forma eficiente através do material. Metais como cobre e alumínio são amplamente utilizados em fios elétricos e sistemas de dissipação de calor devido a essas propriedades.
- Maleabilidade e Ductilidade: Metais são conhecidos por sua capacidade de serem moldados e esticados sem se quebrarem. A maleabilidade refere-se à capacidade de um metal ser deformado em folhas finas, enquanto a ductilidade é a capacidade de ser esticado em fios. Essas propriedades decorrem da flexibilidade das camadas de átomos metálicos, que podem deslizar umas sobre as outras sem romper as ligações metálicas.
- Brilho Metálico: O brilho característico dos metais é resultado da reflexão da luz na superfície metálica, causada pela capacidade dos elétrons livres de absorver e reemitir a luz visível. O brilho metálico é uma consequência direta da interação dos elétrons com a radiação eletromagnética.
- Pontos de Fusão e Ebulição: Metais geralmente têm altos pontos de fusão e ebulição devido à forte atração entre os cátions metálicos e o mar de elétrons. No entanto, há variações dependendo do metal; por exemplo, o mercúrio é um metal líquido à temperatura ambiente devido à fraca força de ligação metálica comparado a outros metais.
Teorias Avançadas e Modelagem da Ligação Metálica
Com o avanço da teoria e da modelagem computacional, a compreensão da ligação metálica tem sido aprimorada. A Teoria do Modelo de Bandas é fundamental para a previsão das propriedades eletrônicas dos metais e suas aplicações. Além disso, simulações por Teoria do Funcional da Densidade (DFT) fornecem informações detalhadas sobre a estrutura eletrônica e as propriedades físicas dos metais, permitindo o desenvolvimento de novos materiais e otimização de processos industriais.
A Teoria do Modelo de Bandas também ajuda a entender a diferença entre metais e semicondutores. Nos semicondutores, a banda de condução está separada da banda de valência por um intervalo de energia que pode ser preenchido ou vazio dependendo das condições, o que não ocorre nos metais.
Aplicações dos Metais
- Indústria e Construção: Metais são amplamente utilizados em construção civil e fabricação de equipamentos devido à sua durabilidade e resistência. O aço, uma liga de ferro e carbono, é um material estrutural fundamental em edifícios, pontes e infraestruturas.
- Eletrônica: Metais como cobre e ouro são essenciais na fabricação de componentes eletrônicos e circuitos integrados devido à sua alta condutividade elétrica. O alumínio também é usado em componentes de alta potência e cabos elétricos.
- Energia e Transporte: Metais são utilizados em sistemas de geração e transmissão de energia, incluindo turbinas, geradores e linhas de transmissão. A leveza e a resistência do alumínio tornam-o ideal para a fabricação de veículos e aeronaves.
- Joalheria e Decoração: A aparência estética e a durabilidade dos metais preciosos, como ouro e prata, os tornam valiosos para joalheria e itens decorativos. Além disso, o platina e o paládio são usados em catalisadores e em diversas aplicações industriais.
Considerações Finais
A ligação metálica é um conceito fundamental na química e na ciência dos materiais, explicando muitas das propriedades únicas observadas em metais. As teorias como o Modelo de Bandas e o Mar de Elétrons proporcionam uma compreensão detalhada de como os metais conduzem eletricidade, calor e como suas propriedades estruturais influenciam suas aplicações práticas. Com o avanço contínuo da ciência dos materiais e da modelagem computacional, a compreensão da ligação metálica e suas aplicações continuará a evoluir, oferecendo novas oportunidades para inovação tecnológica e desenvolvimento de materiais.
Referências
MOTT, N. F.; VAN VLECK, J. H. The Theory of the Properties of Metals and Alloys. New York: McGraw-Hill, 1965.
HALL, R. N. Electronic Structure of Metals and Semiconductors. New York: Academic Press, 1978.
COTTON, F. A.; WILKINSON, G. Advanced Inorganic Chemistry. 6. ed. Nova York: Wiley, 1999.
SILBERBERG, M. S. Química: A Ciência Central. São Paulo: Pearson, 2009.
KRAUS, H. Physical Chemistry of Metals. Berlin: Springer, 1977.